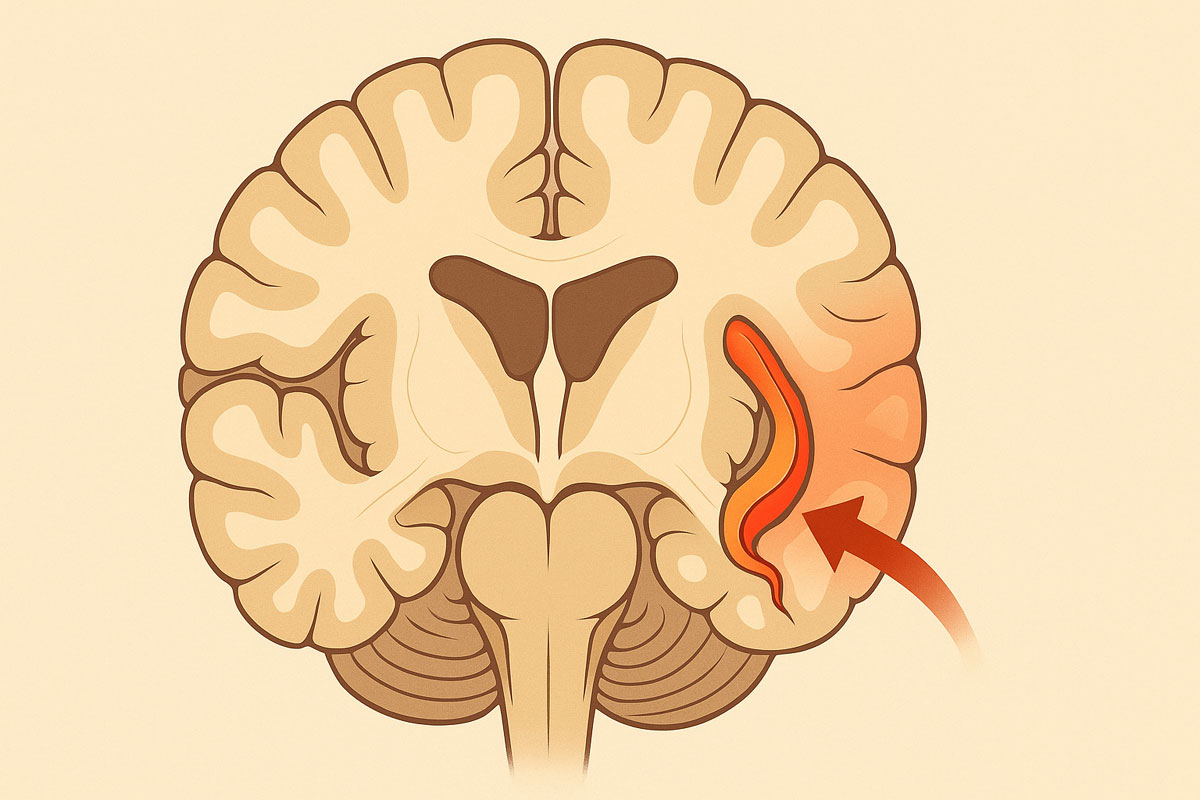
L’hippocampe agit comme une interface majeure pour la consolidation des souvenirs récents et l’orientation spatiale. Chez les personnes âgées, la réduction excessive de son volume, appelée atrophie hippocampique, dépasse la perte neuronale attendue au cours du vieillissement normal. Ce phénomène se manifeste par des oublis invalidants, des hésitations dans le langage et une désorientation progressive. De nombreuses équipes de recherche s’efforcent aujourd’hui d’en préciser les déterminants et de proposer des stratégies de prévention, d’accompagnement et de traitement.
Sommaire
Aspects anatomiques et mécanismes cellulaires
Le tissu hippocampique se subdivise en plusieurs sous‑régions : le gyrus dentelé, la corne d’Ammon (CA1 à CA4) et le subiculum. Dans ce réseau, la connectivité excitatrice repose sur des circuits glutamatergiques, régulés par des interneurones GABAergiques. L’âge conduit à une diminution de la densité synaptique, à l’accumulation de protéines mal repliées et à l’activation chronique de la microglie. Les travaux de neuro‑imagerie montrent que la perte volumique atteint en moyenne 1,5 % par an après 70 ans, avec des pointes de 3 % chez les sujets porteurs de l’allèle APOE ε4.
Au niveau moléculaire, l’excès de cortisol, libéré lors d’un stress prolongé, favorise la phosphorylation anormale de la protéine tau dans la région CA1. Par ailleurs, la réduction de la perfusion artérielle antéro‑choroïdienne limite l’apport en oxygène, accentuant la production de radicaux libres. Cette cascade biochimique mène à la fragmentation des mitochondries, puis au déclenchement d’une apoptose lente mais progressive. La compréhension de ces mécanismes oriente aujourd’hui de nouveaux traitements expérimentaux visant à restaurer la plasticité synaptique.
Signes cliniques précoces
L’expression clinique de l’atrophie hippocampique se révèle d’abord par des difficultés d’organisation temporelle. Le senior ne parvient plus à placer correctement un souvenir récent dans la journée : l’appel téléphonique du matin devient, dans son esprit, un événement de la veille ou de la semaine précédente. Des questions identiques reviennent à intervalles rapprochés, traduisant une instabilité de la mémoire de consolidation.
- Répétition involontaire d’une information déjà donnée à plusieurs reprises
- Incapacité à se repérer dans un épisode télévisé comportant plusieurs fils narratifs
- Confusion entre deux membres de la famille portant un prénom similaire
- Difficulté à retenir un itinéraire de bus récemment modifié par la municipalité
- Erreur dans l’ordre chronologique des événements lors d’une conversation
La personne cherche parfois des stratégies de compensation, comme noter systématiquement chaque tâche dans un carnet. Cependant, la désorientation topographique, même limitée à l’intérieur du quartier habituel, alerte souvent la famille. Les tests d’apprentissage verbal révèlent alors une baisse de l’encodage initial plutôt qu’une récupération déficiente, ce qui différencie cette situation du déficit mnésique lié au vieillissement normal.
Symptômes fonctionnels avancés
Lorsque la perte volumique atteint environ un quart de la taille initiale, on assiste à l’apparition de tableaux plus complexes. La navigation mentale est altérée : le patient ne parvient plus à imaginer un plan ou à se remémorer l’agencement d’un lieu. Dans les tests de stimulation visuelle, il devient incapable d’aligner correctement une carte sur l’environnement réel.
Les troubles comportementaux s’intensifient par phases : irritabilité, repli, épisodes anxieux lors d’une sortie imprévue. Les proches décrivent une sensibilité accrue au bruit et une baisse d’initiative. La personne peut ranger des objets dans des endroits insolites, oubliant immédiatement son geste. À ce stade, une prise de décision indépendante en matière financière ou administrative s’avère risquée.
Les marqueurs psychométriques se modifient également. Dans un MoCA, les scores de rappel différé tombent sous 3/5, tandis que le report sériel et la fluence verbale s’effondrent. Sur le plan neuropsychiatrique, environ un tiers des patients développent un trouble dépressif majeur ou un syndrome anxieux, probablement lié à la conscience partielle des difficultés et à la perte progressive de référent interne.
Bilan diagnostique
Le parcours d’évaluation suit une logique graduée. Il démarre par un entretien médico‑social, destiné à préciser le retentissement sur la vie quotidienne. Ensuite, les batteries cognitives standardisées chiffrent la zone mnésique atteinte, mais l’imagerie occupe une place décisive pour isoler l’hippocampe. Une IRM haute résolution en séquence T1 volumétrique permet une segmentation automatisée. Les logiciels récents, tels que FreeSurfer ou Hipposeg, calculent un score z dérivé de bases de données de sujets témoins du même âge, offrant un repère objectif.
| Technique | Information principale | Points de vigilance |
|---|---|---|
| IRM 3 T | Volumétrie précise des sous‑régions CA1 et gyrus dentelé | Nécessite un positionnement rigoureux |
| TEP FDG | Hypométabolisme temporo‑médial | Exposition au radiotraceur, coût élevé |
| DTI | Intégrité des fibres de substance blanche | Sensible aux mouvements, nécessite une expertise de lecture |
| Spectroscopie 1H | Ratio NAA/Cr, reflet de la viabilité neuronale | Résolution spatiale limitée |
Le bilan biologique parallèle comprend un dosage de la TSH, de l’homocystéine, des folates et de la vitamine B12. Une hypovitaminose D est recherchée, car elle double quasiment la vitesse de déclin hippocampique dans plusieurs cohortes épidémiologiques. Les médecins contrôlent aussi les facteurs vasculaires, l’oxygénation nocturne au moyen d’une polygraphie et, si nécessaire, la présence d’événements micro‑ischémiques silencieux sur une séquence FLAIR.
Approches non médicamenteuses
La littérature récente insiste sur le caractère multimodal de la prise en charge précoce. La stimulation cognitive structurée, pratiquée deux à trois fois par semaine, repose sur des ateliers de mémoire spatiale, des exercices de rappel d’itinéraires et l’utilisation de supports numériques interactifs. Le bénéfice s’explique par l’augmentation de la connectivité fonctionnelle entre l’hippocampe et le cortex préfrontal dorsolatéral.
L’activité physique régulière, notamment la marche rapide, le cyclisme sur terrain plat et les séances d’aquagym, améliore l’angiogenèse cérébrale. Des publications montrent un gain volumétrique modeste, mais significatif, au bout de six mois d’entraînement, mesuré par IRM volumétrique.
La pratique d’exercices de respiration lente, intégrée à des séances de yoga thérapeutique, réduit la réponse cortisolique. Le patient apprend à réguler son stress et à améliorer la qualité du sommeil, facilitant la consolidation mnésique nocturne. Le suivi diététique vient compléter cet éventail : l’apport quotidien en acides gras polyinsaturés, en vitamines E et C, ainsi que l’équilibre glycémique, sont encouragés.
Thérapies pharmacologiques évaluées
Dans les essais cliniques, les inhibiteurs de la cholinestérase (donepezil, rivastigmine, galantamine) démontrent une amélioration transitoire de la mémoire épisodique chez les patients présentant une atrophie hippocampique modérée. Cependant, leur efficacité se stabilise après 12 à 18 mois. Les antagonistes récepteurs NMDA, tels que la mémantine, visent les phénomènes d’excitotoxicité glutamatergique, mais leur impact reste variable selon les profils génétiques, notamment la présence de l’allèle APOE ε4.
Les études sur les ligands du récepteur minéralocorticoïde suggèrent une réduction de la réponse au cortisol et un ralentissement du processus apoptotique. La thérapie hormonale substitutive par œstrogènes exerce un effet neuroprotecteur chez certaines femmes ménopausées, à condition d’être instaurée dans les dix années suivant l’arrêt des cycles. En revanche, ce traitement reste contre‑indiqué en cas d’antécédent thrombo‑embolique.
Les agonistes GABAB de nouvelle génération font l’objet d’essais de phase II. Leur objectif est de rétablir l’équilibre inhibition‑excitation, diminuant la production de bouffées d’activité interictales observées à l’électroencéphalogramme. Les cliniciens surveillent néanmoins les risques de somnolence diurne et de dysfonctionnement exécutif.
Prévention et hygiène de vie
Les campagnes de santé publique insistent sur la gestion des facteurs de risque vasculaire dès la cinquantaine. Une méta‑analyse de 2024, portant sur plus de 40 000 participants, montre un déclin hippocampique annuel inférieur à 1 % chez les sujets ayant maintenu une pression artérielle systolique inférieure à 130 mmHg sur dix ans. De même, un contrôle strict du diabète se traduit par un volume hippocampique préservé, probablement via la réduction de la glycation protéique.
- Activité physique : minimum 150 minutes d’effort aérobie modéré par semaine, associées à deux séances de renforcement musculaire
- Sommeil nocturne : objectif de 7 à 8 heures avec un score de fragmentation inférieur à 20 % sur actimètre
- Nutrition : apport quotidien de 1,1 g/kg de protéines, prédominance de fruits rouges et de légumes crucifères
- Habitudes toxiques : sevrage tabagique et limitation de l’alcool à moins de sept verres standards hebdomadaires
- Engagement social : participation à des activités culturelles hebdomadaires, vecteur de stimulation cognitive
Un indice de masse corporelle stable, situé dans la tranche 22‑27 kg/m2, apparaît associé à un risque réduit de perte volumique rapide. Les chercheurs évoquent le rôle de l’adiponectine, hormone adipocytaire favorable à la plasticité neurale. L’évaluation annuelle de l’audition et de la vision complète la prévention, diminuant la charge cognitive induite par la perte sensorielle.
Soutien aux aidants
L’entourage familial représente un pilier essentiel pour la réussite du programme thérapeutique. Les professionnels proposent un plan d’aide gradué : calendrier partagé sur tablette, rappels vocalisés pour l’heure des médicaments, système de localisation discrète en extérieur. Ces outils sécurisent les déplacements tout en préservant la dignité de la personne concernée.
Les associations de patients et les maisons de santé pluriprofessionnelles organisent des groupes de parole mensuels. Au cours de ces rencontres, les aidants apprennent à anticiper les modifications comportementales et à mettre en place des stratégies de communication bienveillantes. Ces séances réduisent l’épuisement émotionnel, facteur de morbidité bien établi.
Dans les situations avancées, l’intervention d’un ergothérapeute permet d’adapter le logement : étiquetage visuel des placards, éclairage automatique dans les couloirs nocturnes et simplification de l’environnement sonore. Les psychologues spécialisés en gérontologie proposent enfin des séances de thérapie de reminiscence, qui aident à maintenir une identité narrative cohérente.
Perspectives de recherche
La recherche progresse vers des interventions ciblées. Les programmes de thérapie génique, utilisant des vecteurs viraux adéno‑associés pour sur‑exprimer le facteur neurotrophique dérivé du cerveau (BDNF), montrent dans des modèles murins une restauration partielle de la neurogenèse. Par ailleurs, la modulation de la microglie par anticorps monoclonaux anti‑TREM2, testée chez l’humain, pourrait limiter l’inflammation chronique qui accélère la perte neuronale.
Les approches de neuromodulation non invasive, telles que la stimulation magnétique transcrânienne à champ profond, ouvrent un nouvel horizon. Les protocoles actuels ciblent spécifiquement le faisceau perforant, avec une fréquence de 5 Hz, produisant une amélioration des performances de navigation virtuelle de 15 % après six semaines.
L’intelligence artificielle joue désormais un rôle d’assistant diagnostic. Les algorithmes d’apprentissage profond analysent automatiquement les séquences IRM T1 et FLAIR, détectant des patrons de perte volumique subtils que l’œil humain néglige. Cette aide pourrait aboutir à un dépistage systématique lors des bilans de santé des plus de 65 ans.
Enfin, l’économie de la santé examine le coût‑efficacité des programmes de dépistage précoce. Les premières modélisations suggèrent qu’un investissement dans la prévention et l’entraînement cognitif dès 60 ans pourrait réduire de 20 % le nombre de dépendances sévères à horizon de quinze ans, allégeant significativement la charge sur les systèmes de retraite.